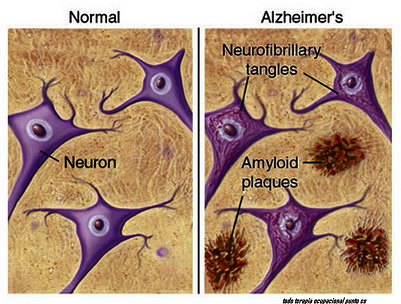
La acumulación de proteína amiloide tóxica en el cerebro es uno de los sellos distintivos de la enfermedad de alzheimer. Un grupo de investigadores de EE.UU. ha intentado escudriñar si la manera como se acumula esta proteína puede estar relacionada con diferentes manifestaciones clínicas de la enfermedad y parece que es así cuando el alzheimer avanza muy rápido, lo que no obstante ocurre de forma muy minoritaria.
Los resultados de su estudio se publican esta semana en la revista Nature y habrá que seguir investigando para entender mejor cómo esas proteínas, llamadas concretamente beta-amiloide, se juntan para formar unas estructuras denominadas fibrillas y cómo esto puede estar relacionado con las características y el avance del alzheimer.
El trabajo, liderado desde los Institutos Nacionales de Salud de EE.UU., es relevante por la forma como se ha llevado a cabo. Según explica a Big Vang por correo electrónico el doctor Wei Qiang, primer autor de la investigación, “representa el primer examen en alta resolución de las estructuras de fibrillas de amiloide derivadas de un grupo de pacientes con alzheimer, y sus potenciales correlaciones con los subtipos clínicos de estos pacientes”.
Para el doctor Juan Domingo Gispert, responsable de investigación en neuroimagen de la Fundación Pasqual Maragall, “lo más interesante es que se trata de una técnica novedosa pero los resultados no demuestran que las variantes estructurales de las fibrillas de amiloide sean las causantes de las variantes clínicas de la enfermedad, especialmente en el caso del alzheimer más común, en el cual la acumulación de proteína se produce durante décadas antes de la aparición de los síntomas”.
Hacer crecer la proteína en muestras de pacientes que murieron
Los investigadores analizaron varias muestras del tejido de la corteza cerebral de 15 pacientes que murieron con distintas manifestaciones de alzheimer. Una de ellas es la más común, que avanza lentamente, y otras dos son minoritarias: una está caracterizada por comportar alteraciones del procesamiento visual y la otra por avanzar muy rápidamente, en cuestión de meses. Además, estudiaron el tejido cerebral de 3 pacientes que murieron sin ser diagnosticados pero que tenían placas de amiloide en su cerebro.
Los autores del trabajo identificaron las fibrillas formadas por proteínas beta-amiloide 40 y beta-amiloide 42 y les añadieron más proteínas del mismo tipo, para que se continuaran acumulando y así estudiar las estructuras que formaban las fibrillas. Después analizaron estas estructuras con una técnica llamada espectroscopia de resonancia magnética en estado sólido para ver si existían diferencias entre aquellos pacientes que tuvieron uno u otro tipo de alzheimer.
Así fue como observaron que las fibrillas de beta-amiloide 40 se estructuran mayoritariamente de una manera muy concreta en los pacientes con la enfermedad de alzheimer más común y también en los que la enfermedad comporta alteraciones del procesamiento visual. En cambio, en quienes la enfermedad avanzó muy rápidamente, beta-amiloide 40 se acumuló de formas más variadas. Por esto, los investigadores hipotetizan que alguna de estas formas podría explicar la rápida progresión de esta variante.
Ahora uno de los próximos pasos, avanzan, es estudiar más a fondo la estructura que predomina en la forma más común de alzheimer.