Los investigadores en el Centro Conjunto de Investigación Planck RIKEN-Max en Japón han demostrado que los síntomas característicos de la enfermedad de Alzheimer pueden reducirse cuando se impide la unión de los azúcares a uno de las enzimas clave implicados en la enfermedad. Los nuevos resultados, publicados en EMBO Molecular Medicine, muestran que la unión anormal de un azúcar particular, a la enzima BACE1 es un factor crítico que conduce a la formación de placas de Aß en el cerebro, y que las placas se reducen y el rendimiento cognitivo mejora cuando esta acción era impedida en ratones a través de la pérdida de la enzima GnT-III. De este modo, este trabajo ha revelado un nuevo mecanismo para el desarrollo de la enfermedad de Alzheimer, potencialmente abriendo el camino a un nuevo enfoque para el tratamiento.
Un factor importante que contribuye a la enfermedad de Alzheimer es la formación de placas de Aß patógenos en el cerebro cuando la molécula APP se corta anormalmente por la enzima BACE1, produciendo Aß. Debido a esto, el desarrollo de fármacos que impiden BACE1 de escisión de APP es un foco central de la investigación de Alzheimer. Un obstáculo importante en estos esfuerzos sin embargo, es encontrar una manera de hacer esto sin molestar a los procesos vitales en el cerebro y el cuerpo que son regulados por la actividad normal BACE1.
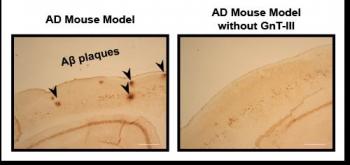
A través de una serie de experimentos, los investigadores dirigidos por Yasuhiko Kizuka, Shinobu Kitazume y Naoyuki Taniguchi en RIKEN, en colaboración con Tamao Endo y Shigeo Murayama en el Instituto Metropolitano de Tokio de Gerontología, mostraron que gran parte de la BACE1 encuentran en el cerebro de la enfermedad de Alzheimer pacientes se modifica por la unión de un azúcar particular, con la ayuda de la enzima GnT-III. La hipótesis de que la prevención de este proceso sería aliviar los síntomas de la enfermedad de Alzheimer, los investigadores cruzaron ratones que carecían de GnT-III con otros que expresan la APP humana en el cerebro. Ellos encontraron que los niveles de Aß y la formación de placas se redujeron en estos ratones híbridos, y que el rendimiento cognitivo fue mejor.
A continuación, se demostró que la eliminación de las versiones azucaradas de BACE1 es eficaz para prevenir la formación de placas porque BACE1 sin el azúcar es destruido y no puede interactuar con APP. El uso de un procedimiento difícil llamado fraccionamiento subcelular, determinaron que BACE1 azucarada se encuentra cerca de APP dentro de las células. Sin embargo, si el azúcar no está unido a ella, se encuentra más lejos de APP y más cerca de los lisosomas – estructuras subcelulares que degradan moléculas que no sean necesarios. Cuando examinaron los ratones que carecían de GnT-III, que de hecho se han encontrado cantidades más bajas de BACE1.
A continuación, mostraron que este enfoque es altamente selectiva. BACE1 normalmente escinde varias proteínas distintas de APP, y mientras que los ratones que carecen de BACE1 también carecen de placas de Aß, ellos también sufren de muchos efectos secundarios y no suelen vivir más de 4 semanas. Por otro lado, los ratones probados por Kizuka y sus colegas están sanos, fértil, y se comportan normalmente. Cuando se examina, estos ratones no mostraron mayores niveles de otras proteínas que normalmente se escinden por BACE1, que muestran que la orientación GnT-III probable que sólo impide BACE1 de escisión de APP, y pueden actuar para reducir la patología de Alzheimer con potencialmente pocos efectos secundarios.
Esta investigación pone de relieve la importancia de la glicosilación – la modificación de proteínas por azúcares. Lejos de ser rara, es la forma más común en el que se altera la estructura de proteínas, con más de la mitad de las proteínas están glicosiladas en los mamíferos. Kizuka se enorgullece de que quizás ahora este proceso obtendrá la atención y presionar que se merece. Él señala que, “a pesar de un cambio de azúcar a menudo se considera sólo un marcador de enfermedad o de un tipo celular específico, nuestro equipo ha demostrado claramente el papel funcional de un glicano durante el desarrollo de la EA.” Agregó que, “este trabajo ofrece una buena oportunidad para que muchos investigadores AD a reconsiderar la importancia de la glicosilación.”
Mientras que la anulación de GnT-III es factible en ratones, un fármaco que inhibe la GnT-III en el cerebro tiene el potencial de ser un tratamiento eficaz para reducir la formación de placa Aß y el deterioro cognitivo en los seres humanos. Con este fin, Kizuka y sus colegas están usando un procedimiento de detección novela en colaboración con el Programa de RIKEN para el descubrimiento de drogas y plataformas tecnológicas Médico para buscar inhibidores GnT-III.